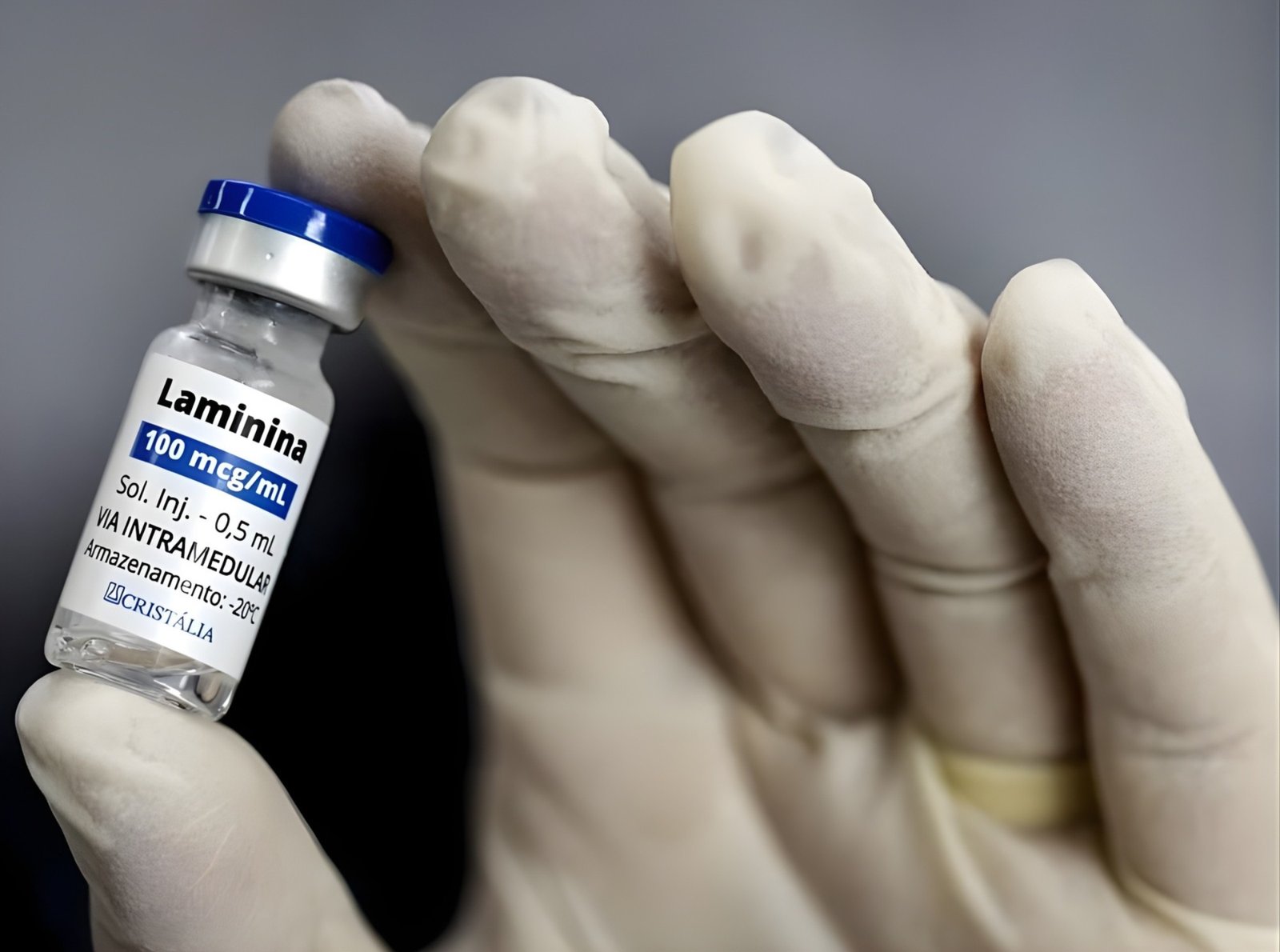
A polilaminina, um novo tratamento destinado a pacientes com lesão medular e perda de movimentos, poderá ser totalmente produzida no Brasil. A farmacêutica Cristália, em parceria com a Universidade Federal do Rio de Janeiro (UFRJ), está à frente do desenvolvimento desse medicamento. Atualmente, as doses que serão utilizadas no estudo de fase 1, que tem como objetivo avaliar a segurança do uso do fármaco, já estão sendo produzidas no país. Esse processo é possível graças à doação de placentas coletadas em hospitais de Itapira, no interior de São Paulo. A polilaminina é feita a partir de uma proteína chamada laminina, isolada da placenta.
Durante o pré-natal, as mulheres grávidas são informadas sobre o projeto de doação de placenta por seus obstetras. Se elas concordam, a placenta é recolhida no momento do parto e acondicionada adequadamente para iniciar o processo de produção do medicamento. Rogério Almeida, vice-presidente do laboratório Cristália, explica que, após a coleta, são realizados testes para verificar a presença de vírus e purificar a amostra. O tempo necessário para a preparação do medicamento varia de dois a três meses. Almeida destaca que o produto será sempre 100% brasileiro, e a expectativa é que a produção continue mesmo após a aprovação total pela Anvisa.
Atualmente, o Brasil enfrenta uma situação em que pacientes buscam acesso ao medicamento por meio da Justiça, devido à urgência de utilizá-lo logo nos primeiros dias após a lesão. Segundo informações da Cristália, já foram protocolados pelo menos 14 pedidos desse tipo, com nove aplicações realizadas até agora. Nesses casos, a empresa forneceu as doses sem custos para os pacientes. É importante ressaltar que essas aplicações não fazem parte do estudo autorizado pela Anvisa e são acompanhadas apenas de maneira remota, sem envolvimento direto dos pesquisadores com os pacientes. Isso significa que relatos de efeitos colaterais ou a evolução dos pacientes não são monitorados pelos desenvolvedores do fármaco.
O estudo clínico em que a polilaminina será testada é a primeira de pelo menos três etapas necessárias para obter a aprovação da Anvisa. Neste estágio inicial, o medicamento será administrado a cinco pacientes para avaliar sua segurança, ou seja, se não há riscos à saúde dos usuários. Em etapas futuras, a eficácia do medicamento será testada em grupos maiores de pacientes, sempre sob supervisão de pesquisadores e com aprovação de comitês de ética. A expectativa é de que os avanços dos pacientes sejam medidos após seis meses e, posteriormente, um ano de uso.
A seleção dos pacientes para o estudo exigirá que eles apresentem apenas fraturas de coluna, sem outras lesões graves associadas, e que cheguem ao hospital em até 72 horas após a lesão, condição que não é comum. Além disso, os pacientes devem ter lesões medulares completas. Alexandre Fogaça Cristante, professor da Faculdade de Medicina da USP e investigador principal da pesquisa, ressalta a importância de um critério rigoroso na seleção dos participantes. O tratamento será administrado durante uma cirurgia que os pacientes com lesão medular geralmente precisam realizar.
O caminho para a chegada da polilaminina às fases clínicas leva 25 anos desde o início das pesquisas conduzidas pela professora Tatiana Sampaio, que lidera o Laboratório de Biologia da Matriz Extracelular, no Instituto de Ciências Biomédicas da UFRJ. Tatiana, que também faz parte do comitê da Cristália, colaborará com a documentação que será enviada à Anvisa durante o estudo. Entre 2018 e 2021, o uso do medicamento em humanos já foi realizado no Brasil dentro de um estudo clínico acadêmico, com resultados que geraram esperança. Durante essa fase, foi utilizado um princípio ativo do medicamento em pequena escala, mas os resultados ainda não são suficientes para determinar o tempo necessário para que os pacientes respondam ao tratamento. A expectativa é que, com um número maior de aplicações no futuro, seja possível entender melhor como diferentes tipos de lesões reagem ao uso da polilaminina.